## 同素异形体
**同素异形体定义:**
**单质**由一种元素组成,而具有相同化学性质但排列方式不同的单质被称为**同素异形体**。
## 同素异形体条件:
– 由**相同元素**组成。
– 元素在不同形态中排列方式不同。
## 同素异形体举例:
– **磷:**白磷、红磷和黑磷
– **氧:**氧气(O2)和臭氧(O3)
– **碳:**石墨、金刚石、C60
## 非同素异形体举例:
– **一氧化碳(CO)和二氧化碳(CO2):**虽然由不同元素组成,但性质不同,但不是同素异形体,因为它们包含两种不同的元素。
## 磷的同素异形体:
**白磷:**
– 白色蜡状固体,遇光变黄
– 有蒜味
– 自燃点低(40℃)
– 有毒,会对人体器官造成严重损伤## 白磷与红磷
### 一、白磷的性质
- **接触方式:** 人体可以通过三种途径接触白磷:误食、吸入含有白磷的空气、皮肤接触。
- **皮肤接触处理:** 若皮肤接触白磷,应立即使用2%~3%的硝酸银溶液灭磷火,并用大量的流动清水冲洗。如有不适,请尽快就医。
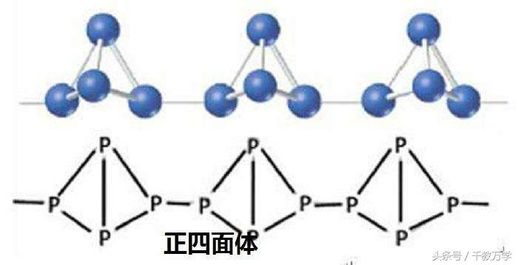
- **化学式:** P4
- **结构:** 四个磷原子构成正四面体结构。
- **溶解性:** 白磷不溶于水,易溶于二硫化碳。
- **热稳定性:**
* 在隔绝空气条件下加热至533K,白磷转化为红磷。
* 在1200MPa压力下加热至473K,白磷转化为黑磷。
#### 1.1 白磷的燃烧
白磷在充足的氧气中燃烧生成白色固体五氧化二磷(化学式:P2O5),并产生大量白烟(由五氧化二磷固体小颗粒组成),该烟尘有毒。

#### 1.2 白磷的储存
白磷化学性质活泼,暴露在空气中易与氧气反应自燃,挥发的白磷蒸气被人吸入会导致中毒。 由于白磷不溶于水且密度小于水,因此通常将白磷保存在水中。

#### 1.3 白磷的应用
白磷可用于制作烟幕弹等。


- **白磷在氧气中燃烧的文字表达式与化学方程式:**

### 二、红磷的性质
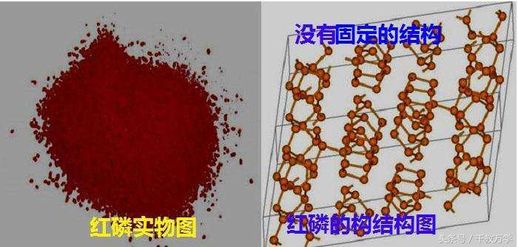
- **外观:** 红磷(也称赤磷)是紫红色略带棕色的粉末状固体,无气味,无毒,在暗处不发磷光。
- **着火点:** 红磷在空气中加热到240℃时开始燃烧。
- **溶解性:** 不溶于水和二硫化碳。
- **化学式:** P
- **结构:** 红磷结构比较复杂,用P表示。
- **稳定性:** 比白磷化学性质稳定。
#### 2.1 红磷的燃烧
红磷在氧气中燃烧生成白色固体五氧化二磷(化学式:P2O5),并产生大量白烟(由五氧化二磷固体小颗粒组成)。
- **红磷在氧气中燃烧的文字表达式与化学方程式:**

#### 2.2 红磷的储存
密封储存在阴凉通风处。

#### 2.3 红磷的应用
红磷可用于火柴盒上的涂层(主要成分是红磷和玻璃粉),以及制造农药等。

### 三、白磷与红磷的区别
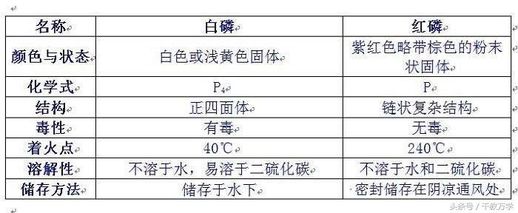
- **外观:** 白磷为白色或黄色固体,有剧毒;红磷为紫红色粉末,无毒。
- **着火点:** 白磷着火点低(约40℃),易自燃;红磷着火点较高(约240℃)。
- **溶解性:** 白磷不溶于水,易溶于二硫化碳;红磷不溶于水和二硫化碳。
- **化学性质:** 白磷化学性质比红磷活泼。
- **毒性:** 白磷有剧毒,红磷无毒。
- **储存:** 白磷需储存在水中,红磷只需密封保存于阴凉干燥处。